Aufbauend auf dem Medizinproduktegesetz!
Medical Device Regulation (MDR)
Zur aktuellen Umfrage, bitte nach unten scrollen!

So planen wir die MDR in mmOrthosoft® zu integrieren:

Medizin Produkte Verordnung (MDR) mit mmOrthosoft®
Die Anforderungen der Medical Device Regulation kurz MDR (26.05.2021) lassen sich in der Regel mit den bereitgestellten Programmmodulen von mmOrthosoft® umsetzen. Auf Basis des Programm-Modul Warenwirtschaft, Programm-Modul Rehamittelverwaltung, Programm-Modul Textverwaltung und besonders das Programm-Modul eQM-Handbuch sind für diese Aufgabenstellung geeignet, da teilweise ein eigenes QM-Management System gefordert wird.
Generelles:
-
![]()
In allen Belegen Kostenvoranschläge (Angebot), genehmigte KVs (Auftrag), Lieferscheine, Rechnungen, Rezepte und Rehamittellager werden in den Positionen ein oder mehrere UDIs als Eingabe(n) realisiert.
Die Eingabe kann als manuelle Tastatureingabe oder über 2-D Barcodescanner direkt am Karton abgescannt werden. -
Direkt in den Positionen werden die MDR Felder wie "Ablaufdatum" verwaltet.
Es wird weitere Informationen geben, die zusätzlich zu den UDIs in den Positionen verwaltet werden.
Für den reinen Händler:
-
Der reine Händler muss alle Unterlagen wie Konformitätserklärungen für Kaufprodukte ablegen, verwalten und im Zugriff halten.
-
Zusätzliche Infofelder wie Erinnerungen werden zusätzlich pro Position abgespeichert.
Zusätzlich für den Hersteller von Sonderanfertigungen:
-
Welche MDR Besonderheiten gelten für den Hersteller?
-
Wie sieht einen Konformitätserklärung-Sonderanfertigung aus?
-
Konformitätserklärung Beispiel #1
-
Konformitätserklärung Beispiel #2
-
Konformitätserklärung Beispiel #3
-
Konformitätserklärung DGIHV Vorschlag
-
Hilfsmittelpass Beispiel
-
Der Hersteller muß wie der reine Händler alle Unterlagen wie Konformitätserklärungen für Kaufprodukte ablegen, verwalten und im Zugriff halten.
Zusätzlich muß der Hersteller bei der Produktion eigener Produkte eine eigene Konformitätserklärung für das Endprodukt erstellen und dem diese Konformitätserklärung dem Patienten zur Verfügung stellen. -
Im wesentlichen müssen folgende Informationen auf einer Konformitätserklärung aufgeführt sein:
Leistungserbringer, Name, Anschften etc.
Produktbeschreibung
Produktserriennummer
- Ursprungsmaterial
- Zusatzmaterialien
- ...& Rezept ( wenn verfügbar)
-
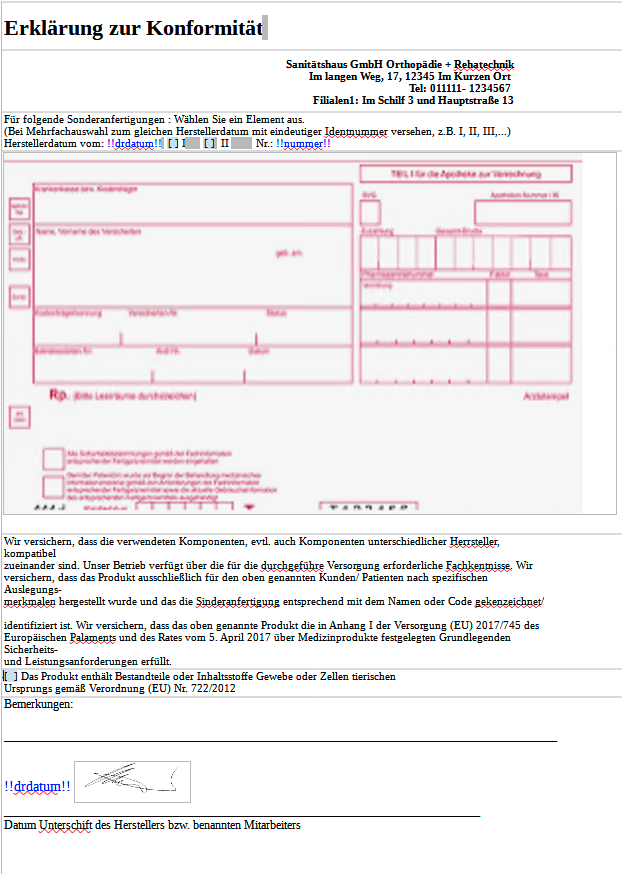
Erklärung zur Konformität
Sanitätshaus GmbH Orthopädie + Rehatechnik
Im langen Weg, 17, 12345 Im Kurzen Ort
Tel: 011111- 1234567
Filialen1: Im Schilf 3 und Hauptstraße 13Für folgende Sonderanfertigungen : Wählen Sie ein Element aus.
(Bei Mehrfachauswahl zum gleichen Herstellerdatum mit eindeutiger Identnummer versehen, z.B. I, II, III,...)
Herstellerdatum vom: !!drdatum!! [ ] I [ ] II Nr.: !!nummer!!Wir versichern, dass die verwendeten Komponenten, evtl. auch Komponenten unterschiedlicher Herrsteller, kompatibel
zueinander sind. Unser Betrieb verfügt über die für die durchgeführe Versorgung erforderliche Fachkentnisse. Wir
versichern, dass das Produkt ausschließlich für den oben genannten Kunden/ Patienten nach spezifischen Auslegungs-
merkmalen hergestellt wurde und das die Sinderanfertigung entsprechend mit dem Namen oder Code gekenzeichnet/
identifiziert ist. Wir versichern, dass das oben genannte Produkt die in Anhang I der Versorgung (EU) 2017/745 des
Europäischen Palaments und des Rates vom 5. April 2017 über Medizinprodukte festgelegten Grundlegenden Sicherheits-
und Leistungsanforderungen erfüllt.[ ] Das Produkt enthält Bestandteile oder Inhaltsstoffe Gewebe oder Zellen tierischen
Ursprungs gemäß Verordnung (EU) Nr. 722/2012Bemerkungen:
_______________________________________________________________________________
!!drdatum!!
___________ __________________________________________________________
Datum Unterschift des Herstellers bzw. benannten MitarbeitersKonformität AS 01.docx
-
Erklärung zur Konformität
Sanitätshaus GmbH Orthopädie + Rehatechnik
Im langen Weg, 17, 12345 Im Kurzen Ort
Tel: 011111- 1234567
Filialen1: Im Schilf 3 und Hauptstraße 13Für folgende Sonderanfertigungen : Wählen Sie ein Element aus.
(Bei Mehrfachauswahl zum gleichen Herstellerdatum mit eindeutiger Identnummer versehen, z.B. I, II, III,...)
Herstellerdatum vom: !!drdatum!! [ ] I [ ] II Nr.: !!nummer!!Versichertenname: !!I_strasse!! !!I_name1!!
Adresse: !!I_strasse!! !!I_plz!! !!I_ort!!
Geb. am: !!I_gebdat!!
Verordnungstext Arzt /Einrichtung !!a_anrede!! !!a_name1!!
Verordnungstext: Klicken hier, um ein Text einzugeben
Klicken hier, um ein Text einzugeben
Klicken hier, um ein Text einzugeben
Klicken hier, um ein Text einzugeben
Klicken hier, um ein Text einzugebenWir versichern, dass die verwendeten Komponenten, evtl. auch Komponenten
unterschiedlicher Herrsteller, kompatibel zueinander sind. Unser Betrieb verfügt über die für die
durchgeführe Versorgung erforderliche Fachkentnisse. Wir versichern, dass das Produkt
ausschließlich für den oben genannten Kunden/ Patienten nach spezifischen
Auslegungsmerkmalen hergestellt wurde und das die Sinderanfertigung entsprechend mit dem
Namen oder Code gekenzeichnet/ identifiziert ist. Wir versichern, dass das oben genannte
Produkt die in Anhang I der Versorgung (EU) 2017/745 des Europäischen Palaments und des
Rates vom 5. April 2017 über Medizinprodukte festgelegten Grundlegenden Sicherheits- und
Leistungsanforderungen erfüllt.[ ] Das Produkt enthält Bestandteile oder Inhaltsstoffe Gewebe oder Zellen tierischen
Ursprungs gemäß Verordnung (EU) Nr. 722/2012Bemerkungen:
___________________________________________________________________
!!drdatum!!
___________ __________________________________________________
Datum Unterschift des Herstellers bzw. benannten Mitarbeiters -

-

-
Beispiel für einen Hilfsmittelpass von Sanitätshaus Bahr:



Allg. Informationen, Definitionen, Stichworte usw.
-
Programmodul MPG
-
Zeitplan
-
Spezielle QR IT Komponenten
-
Erweiterte Nummernkreise
-
UDI, UDID
-
Rückverfolgbarkeit
-
EUDAMED Datenbank
-
Qualitätsmanagement
-
Qualifizierte Person
-
MP-Berater
-
Meldepflicht
-
MPG / MPDG
-
AiDC
-
Etiketten Beispiele
-
Ein separates Programm-Modul MDR war nach erster Einschätzung nicht erforderlich. Es wird aber doch einige Programmanpassungen geben.
Alle Vorgaben zur Klassifizierung, Zulassung und Einführung von Medizinprodukten:
MPG Medizin Produkte Gesetz
MPDG Medizin Produkte Durchführungs Gesetz -
MDR Zeitplan:
2017
Die MDR wurde am 05.05.2017 veröffentlicht und tritt somit am 25.05.2017 in Kraft. 2021
Es gilt eine Übergangsfrist von 3 Jahren bis zum 25.05.2020.
(Aufgrund Corona geändert auf 26.05.2021)2022
Geplante Veröffentlichung der "European Databank on Medical Devices" kurz EUDAMED im Jahr 2022 2024
Bis zum 26. Mai 2024 behalten MDD-Zertifikate noch ihre Gültigkeit (z.B. für Produkte der Risikoklassen II und III), es sei denn, es ist vorgeschrieben, das MDD-Zertifikat durch ein MDR-Zertifikat zu ersetzen (z.B. für Produkte der Risikoklasse I). Wichtige Ergänzung auf Anfang 2020:
Aufgrund der aktuellen Situation, dass es viel zu wenige "Benannten Stellen" gibt und der "Corona-Krise" wurde eine Verlegung auf den 26.05.2021 von der EU beschlossen. -
![]()
Wir werden spezielle Quick Response kurz QR - fähige Komponenten freigeben.
Bitte stimmen Sie sich vor einer Anschaffung von QR - fähigen Druckern, Scannern und Etiketten etc. auf jedenfall vorher mit uns ab ! -
Bereits vorhandene Nummernsysteme:
- Interne Ein- eindeutige Artikel Nr.
- Seriennummer
- Chargennummer
- Verfallsdatum
- EAN
- PZNNeu gefordertes Nummernsystem:
- UDI Unique Device Identification (Im QR Code)
- UDID Unique Device Identifier
Je nach Bedarf werden wir die entsprechenden Daten editierbar machen. An diesen Stellen sollten dann auch Scanner eingesetzt werden können. -
![]()
UDI Unique Device Identification
Die UDI besteht aus zwei Teilen, dem UDI-DI („Device Identifier“) für die Identifikation von Produkt und Hersteller und dem UDI-PI („Production Identifier“), der die Charge eines Produktes markiert. Die so genannte Basis-UDI-DI, eine Art Modellkennzeichnung, dient als Schlüssel für die UDI-Datenbank und umfasst gleichartige Produkte mit gleicher Zweckbestimmung und Risikoklasse. (bvmed)
-
10 Jahre Konform der steuerlichen Aufbewahrungspflicht
Ausnahmen: Implantate = 15 Jahre !
-
![]()
Sollte die Eudamed Fremdabfragen über Schnittstellen zulassen, werden wir Abfragen bei Bedarf realisieren.
Derzeit geplant:
Abfrage einzelner UIDs.
Abfrage zurückgerufener UIDs.Die "European Databank on Medical Devices" kurz EUDAMED soll alle relevanten Informationen zu den europäischen Medizinprodukten aufnehmen. Statt einer modulweisen Freigabe wird die komplette Freigabe im Jahr 2022 anvisiert.
-
Wir bieten ein eigenes Programmodul QM-Handbuch mit Integration in mmOrthosoft® an. Eine genaue Beschreibung finden Sie hier:
Direktlink zu: Beschreibung mmOrthosoft(R) Modul eQM HandbuchMit diesem Modul können Sie ein eigenes QM-Handbuch erarbeiten oder Vorlagen von Drittanbietern wie z.B. vom BIV-OT einarbeiten.
-
![]()
Bestimmung einer qualifizierten Person für die Einhaltung der regulatorischen Vorschriften.
-
Den Medizin Produkte Berater Wird es auch weiterhin in gleicher Funktion geben. Auch die Qulifizierungsvorgaben werden unverändert übernommen.
- Naturwissenschaftlicher, medizinischer oder technischer Beruf oder- Mindestens einjährige Tätigkeit im diesem Beruf
- Absolvierte Seminare & jährliche Auffrischungsseminare -
![]()
Verschärfte Meldepflicht bei Vorkommnissen
-
MPG Medizin Produkte Gesetz
MPDG Medizin Produkte Durchführungs Gesetz -
Automatic Indentification and Data Capture (AIDC)
Automatische Identifikation und Datenerfassung:UDI-Bestandteile:
MDR-Feld
Typ ID ID UDI-DI (Unique Device Identification, Eindeutige Geräte Identifikation) N 4-22 9N 01 LOT (Charge) AN (C) 1-20 1T 10 EX-Date (Expiration Date, Ablaufdatum) N 6 JJMMTT D 17 MA-Date (Manufactoring Date, Herstellungsdatum) N 8 JJJJMMTT 16D 11 SN# (Seriell Nr., Seriennummer) AN (C) 1-20 S 21 Sonstige Felder: ITEM N. (Artikel/Produktnummer) MODEL N. (Modell-Nr.) CATALOG NUMBER (Katalognummer) MANIFACTURE (Hersteller, Name, Anschrift) N ? ? QUANTITY (Stückzahl, Anzahl, Einheiten) STORAGE / HANDLING (Handhabung, Lagertemparatur) SIZE (Grössenangabe) COLOR (Farbe) DESIGN (Entwurf) SIDE (Seite) PZN (Pharma Zentralnummer) REF () Hi.Mi/Pos.-Nr./HMVN () xx.xx.xx.xxxx TYPE (Ausführung) LOCATION (Lage/Ort) DESCRIPTION (Beschreibung) WEIGHT (Gewicht) -
Hier haben wir ein paar typische Etiketten zusammengetragen:




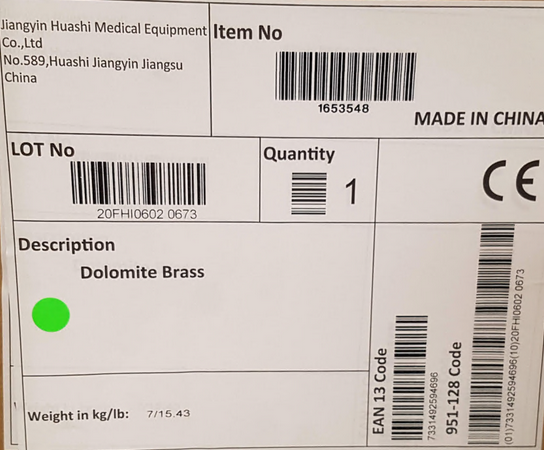

MDR Leitfäden & Links
-
mmOrthosoft® Leitfaden
-
DGIHV Leitfaden für Händler
-
DGIHV Leitfaden für Hersteller von Sonderanfertigungen
-
Diverse Links / Videos zur MDR
-
Bei der Medical Device Regulation kurz MDR handelt es sich im wesentlichen um eine europäische Verordnung die ab dem 6. Mai 2021 verpflichtend anzuwenden ist.
>>>Direktlink zur Medical Device Regulation (MDR) (dimdi.de)<<<
Für unsere Anwender bedeutet das im wesentlichen deutlich erhöhte Dokumentationspflichten.
Wir als Softwareanbieter bieten in den Artikelstammdaten die Auflösung der UDI / UDID, die erweiterte Dokumentation obliegt dem Anwender je nach Sachverhalt.
Da jeder Anwender verpflichtet ist ein Qualitätsmanagement Handbuch zu führen, empfehlen wir ihnen den Einsatz unseres Programm-Moduls eQM Handbuch. -
![]()
Die "Deutsche Gesellschaft für interprofessionelle Hilfsmittelversorgung e.V. (DGIHV)" hat auf ihrer Webseite "www.gfihv.org/mdr" einen Leitfaden für Händler veröffentlicht.
-
![]()
Die "Deutsche Gesellschaft für interprofessionelle Hilfsmittelversorgung e.V. (DGIHV)" hat auf ihrer Webseite "www.gfihv.org/mdr" einen Leitfaden für Hersteller von Sonderanfertigungen veröffentlicht.
-
https://www.medi.de/fachhandel/wissen/beraten-verkaufen/mdr-unterstuetzung/
https://www.mtd.de/78-sani-welt/1215-die-aufgaben-der-mdr-fuer-sanitaetshaeuser
https://www.gesundheitnordost.de/service/mdr/
https://meso.vde.com/de/udi-unique-device-identification-medizinprodukte-mdr/
https://e-learning.vorest-ag.com/pluginfile.php/32079/mod_resource/content/4/scormcontent/index.html#/lessons/vZUj5en3RHgxwN8t4xhdsPxNV1dVOZAghttps://www.youtube.com/watch?v=ANVeNKm6qxY
https://www.youtube.com/watch?v=T7OpCk0DEA4
Umsetzung der MDR in mmOrthosoft® Version21.2ff
-
Schritt 1 Eingabe der UDI
-
Schritt 2 Suche der UDI
-
Schritt 3 Konformitätserklärung(en)
-
Schritt 4 Vollständige Einbindung in die WaWi
-
Schritt 5 Integration verschiedener Funktionen
-
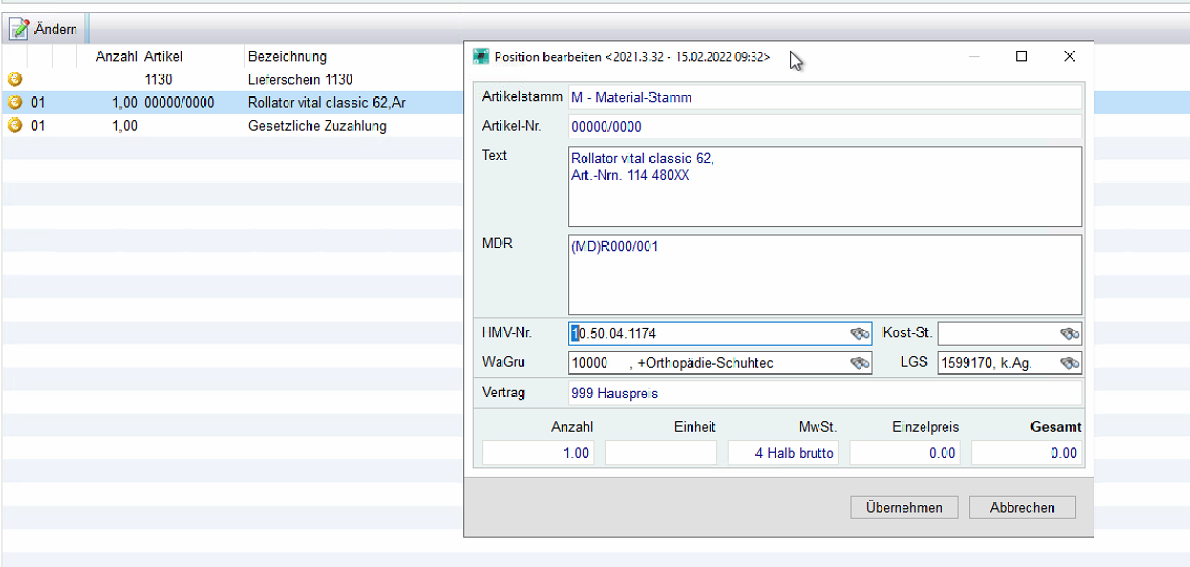
Öffnen des Artikelstamms
Hinterlegen der EAN Nummer beim Artikel

Im Suchbegriff der Artikeleingabe bei Belegen und/oder Ladenkasse, ist es möglich eine UDI einzutragen oder einzuscannen. mmOrthosoft® versucht aus der UDI die EAN Nummer auszulesen und sucht automatisch den Artikel mit der dazugehörigen EAN Nummer
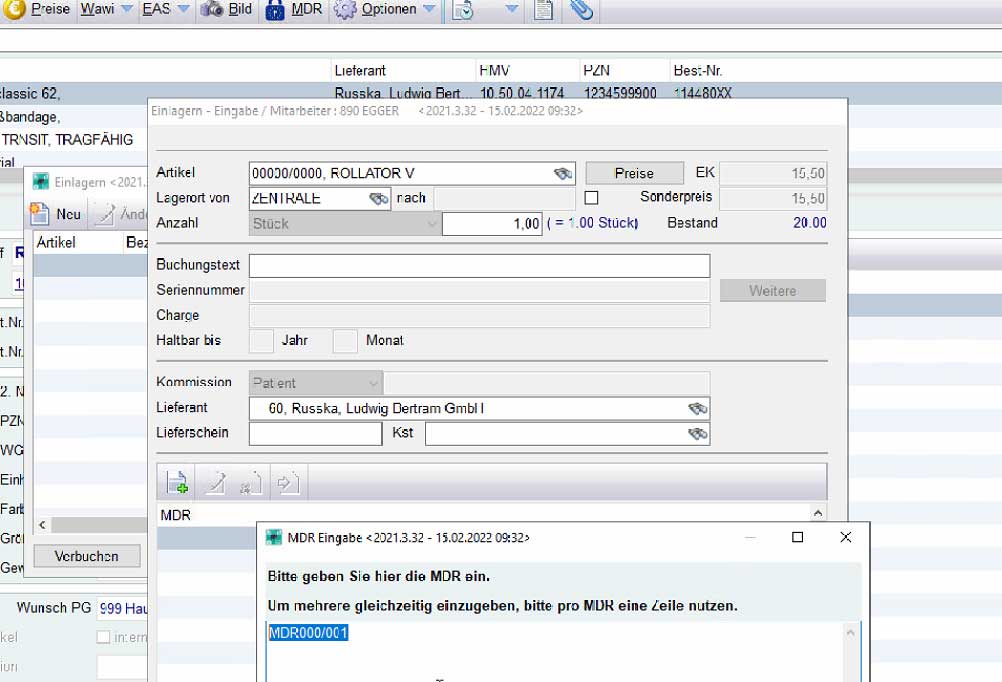
Über den Button hinzufügen haben Sie die Möglichkeit weitere UDIs dem Artikel hinzuzufügen
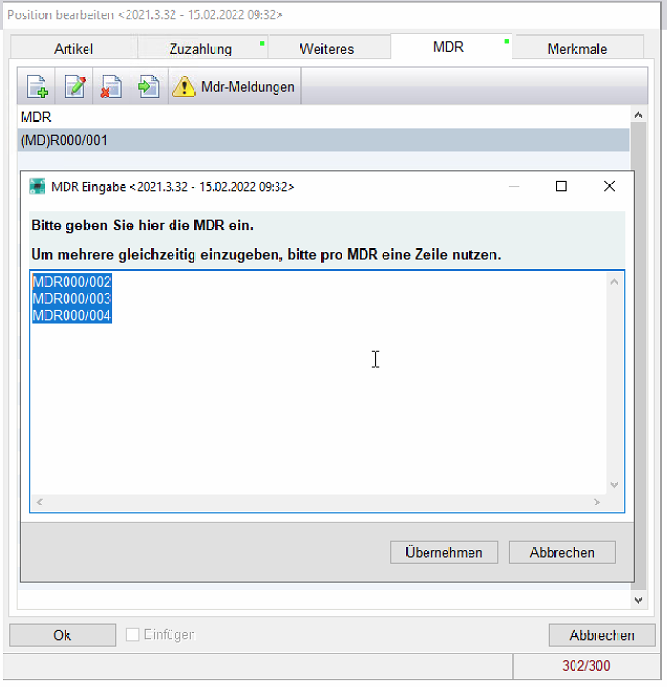
Sollte eine UDI erkannt werden wird diese automatisch im Reiter MDR hinterlegt.

Sollten wir Unstimmigkeiten erkennen, können Sie sich diese über die MDR Meldungen anzeigen lassen.
(MDR Anzahl nicht stimmig mit Artikelanzahl oder doppelte MDR Nummern, etc.)
Im Reiter MDR wird mit einem grünem Punkt angezeigt, wenn UDI hinterlegt sind
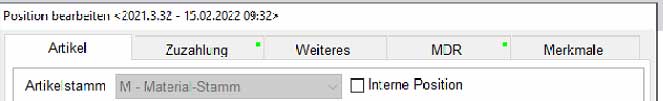
Die UDI der Positionen werden bei Überträgen in andere Belege automatisch übernommen.

Die Eingabe der UDI ist auch in der Ladenkasse möglich
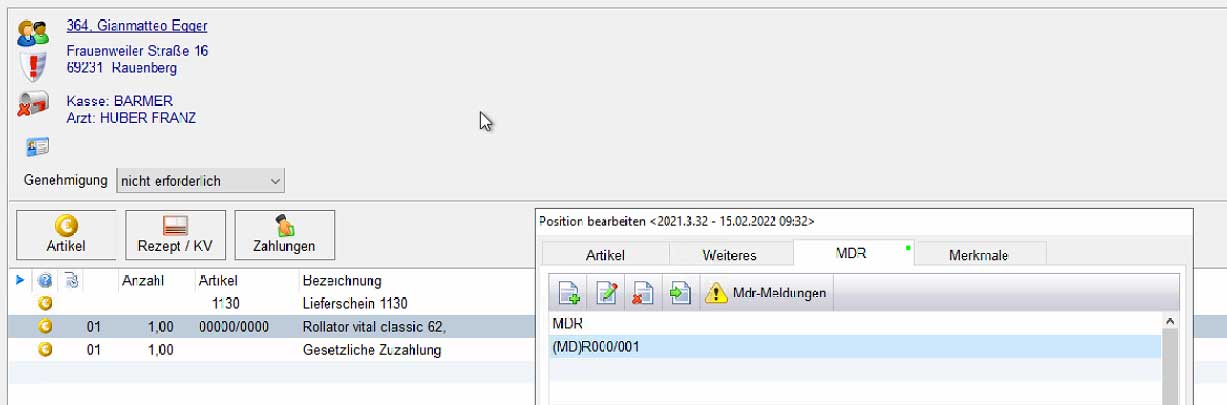
Im Ladenkassenstamm sind die UDI wie im folgenden Bild dargestellt.
-
Über die MDR Suche im Material, können Sie sehen über welche Belege welche UDI herausgegeben wurden.
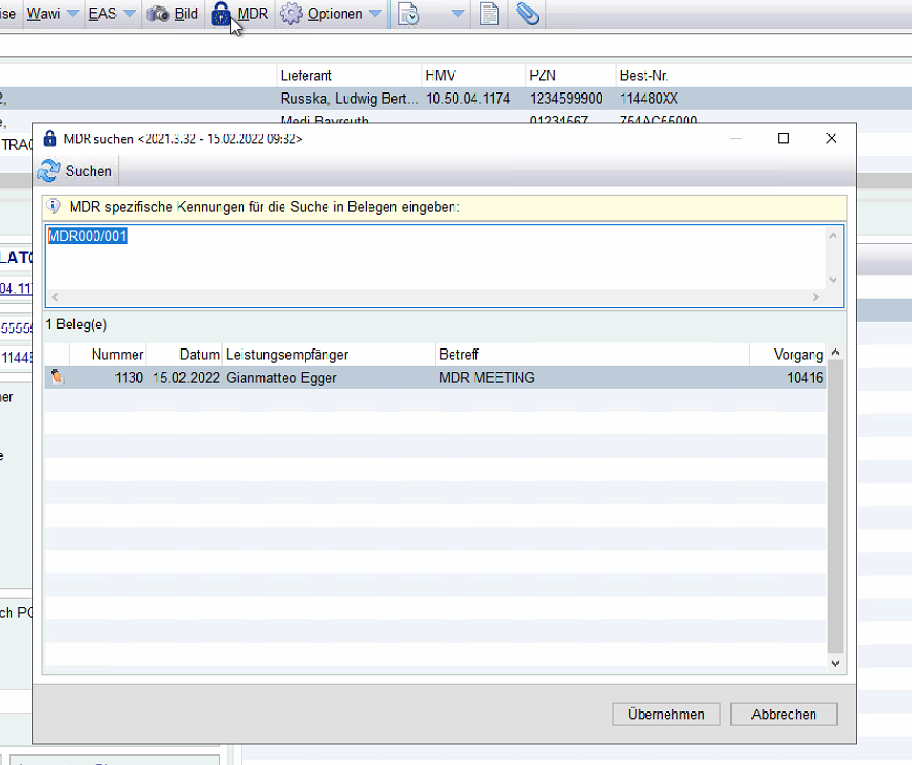
-
Beispiele Konformitätserklärung:


-
![]()
in Arbeit
-
![]()
in Arbeit
z.B. Verfallsdatum, Etikettendruck, uvm.
Zu diesem Thema fanden bereits Online Kundentreffen statt.
Lesen Sie hier! mehr darüber.
Häufige Fragen
zur Medical Device Regulation (MDR).
- wird es ein eigenen Programm-Modul MDR geben?
Derzeit sehen wir keinen Bedarf ein eigenes Programm-Modul MDR zu planen. Es wird aber an verschiedenen Stellen im Programm kleine MDR Anpassungen geben.
- Wird der QR Code unterstützt ?
Kostenlos Kontakt aufnehmen
Zum Thema MDR






